Los microorganismos causantes de la viruela del mono, del herpes simple y del papiloma humano, algunos casos

Viernes 25 de noviembre de 2022, p. 8
Científicos españoles del Centro Nacional de Investigaciones Oncológicas (CNIO) e ingleses de la Universidad de Sussex descubrieron el mecanismo que ayuda a virus como el de la viruela del mono a bloquear y burlar el sistema de defensa celular.
Un mecanismo que tienen las células humanas frente a virus como el de la viruela del mono, el del herpes simple y el del papiloma humano –todos ellos con ADN de doble cadena– se basa en proteínas que patrullan por la célula a modo de sensores del material genético del microorganismo. Se trata de un tipo de defensa descubierto hace una década y poco estudiado.
Cuando las proteínas sensor detectan ADN viral se enlazan a él, y salta entonces la alarma: la célula activa sus defensas. Sin embargo, el virus también tiene proteínas capaces de bloquear ese sistema de alerta, explicaron los científicos por medio de un comunicado.
Una de esas proteínas que alerta a las células de la presencia de virus de ADN es el complejo Ku. Los investigadores consiguieron caracterizar su estructura tridimensional a nivel atómico, acoplada a la de las moléculas virales capaces de bloquearlo. El hallazgo, que se publica en la revista Nature Communications.
Los investigadores han trabajado con el virus Vaccinia (utilizado en el desarrollo de la vacuna contra la viruela y perteneciente a la familia de los poxvirus). Dos proteínas de este microorganismo, denominadas C4 y C16, se unen a Ku y bloquean su acción, inactivando así la respuesta inmune celular. Conocer la forma de estas proteínas, su estructura tridimensional, ayuda a entender cómo lo hacen.
Ku tiene forma de anillo, con un hueco central que utiliza para enhebrase en el ADN. Los investigadores descubrieron que las dos proteínas del virus son como tapones que cubren ese espacio, bloqueando su capacidad de reconocer el material genético viral.
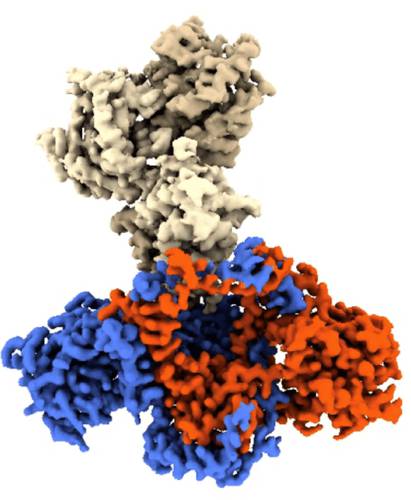
Estructura del grupo C16-Ku
Los expertos, liderados por Óscar Llorca, obtuvieron la estructura del complejo C16-Ku a través de criomicroscopía electrónica, técnica que permite visualizar las interacciones entre la proteína vírica y la humana.
De esta forma, los autores del trabajo identificaron qué parte de la proteína vírica causa el bloqueo de Ku.
El grupo de la Universidad de Sussex, liderado por Laurence H. Pearl, confirmó que el mecanismo de acción de la proteína C4 es muy similar al de C16.
El complejo Ku también está presente en el núcleo de las células, pero su papel ahí no es alertar de la presencia de virus sino reparar nuestro propio material genético cuando está dañado.
El grupo de Llorca estudia en el cáncer el papel de complejos como Ku, involucrados en la reparación del ADN de doble cadena. Cuando estos mecanismos de reparación actúan en células tumorales favorecen su supervivencia.
Ahora que se sabe, gracias al nuevo trabajo, cómo los virus bloquean la acción de Ku, se podría aprender a alterar su papel en la reparación de roturas en el ADN de células tumorales.
“La idea de esta investigación surgió porque si en un tratamiento para generar daños en el ADN de las células tumorales pudiéramos bloquear el funcionamiento de Ku durante el proceso de reparación del ADN, de manera similar a como lo hacen los virus, el tratamiento sería aún más eficaz”, indicó Ángel Rivera-Calzada, coautor principal del trabajo.
Uno de los siguientes pasos será evaluar si emular el mecanismo de las proteínas virales para bloquear Ku serviría para desarrollar una estrategia que ampliará el efecto de los tratamientos contra el cáncer.
“De toda la proteína vírica, es una porción de unos pocos aminoácidos la que actúa bloqueando la acción de Ku”, señaló Rivera-Calzada. El primer paso sería confirmar que esos pequeños fragmentos producidos en el laboratorio son capaces de bloquear el reconocimiento del ADN dañado. Para ello los autores del trabajo confían en colaborar con expertos del CNIO en este tipo de estrategias.