A finales de diciembre, GlaxoSmithKline surtirá 10 millones de dosis contra el virus A/H1N1
Las reacciones reportadas se deben a que el antígeno contiene un coadyuvante, explica Birmex
Miércoles 25 de noviembre de 2009, p. 36
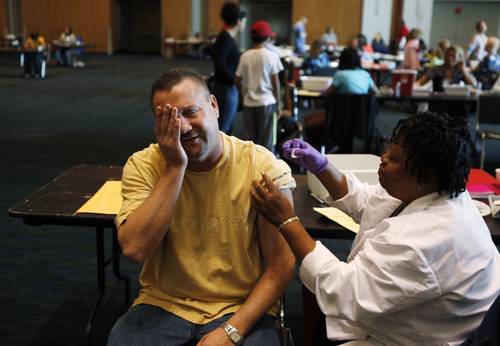
México comprará al laboratorio GlaxoSmithKline (GSK) 10 millones de dosis de la vacuna contra la influenza A/H1N1, las cuales empezarán a llegar a finales de diciembre, informó Samuel Ponce de León, director de Biológicos y Reactivos de México (Birmex), laboratorio propiedad del gobierno federal responsable del resguardo y distribución del producto.
Explicó que las reacciones alérgicas reportadas en Canadá –en un lote del producto– se deben a que además del antígeno, el biológico de GSK contiene un coadyuvante, el cual incrementa la respuesta del organismo para la creación de anticuerpos.
Descartó que haya motivo de preocupación respecto a la calidad de la vacuna, y recordó que a la fecha se han aplicado 80 millones de dosis en el mundo. De la fabricada por GSK se han distribuido 15 millones de dosis sólo en Canadá, informó ayer el corporativo.
En entrevista, Ponce de León advirtió sobre la importancia de “no generar desconfianza más allá de lo razonable”, porque el antígeno es seguro y, de acuerdo con las investigaciones realizadas, su efectividad es de 90 por ciento, lo que significa que quienes lo reciban tendrán un riesgo de apenas 10 por ciento de infectarse con la nueva cepa y, en caso de enfermedad, la posibilidad de desarrollar complicaciones se reduce al mínimo.
Vigilancia estricta de Cofepris
De cualquier manera –dijo–, en México también habrá vigilancia estricta para detectar eventuales efectos adversos, mientras la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) evaluará la calidad de los biológicos que el gobierno federal compró a GSK y al laboratorio Sanofi-Pasteur.
Explicó que de cada lote que llegue a territorio nacional, se reservará y mantendrá bajo resguardo una muestra para el análisis de la Cofepris, aunque la distribución empezará de inmediato porque es urgente aplicarla antes del inicio del invierno en los sectores de más alto riesgo, como el personal de salud, en particular el que se encuentra en las áreas de urgencia y terapia intensiva de los hospitales, así como entre las embarazadas.
Respecto a las 875 mil dosis de la vacuna fabricada por Sanofi que llegaron al país entre el jueves y el lunes pasados, el funcionario informó que entre ayer y hoy se empezarían a distribuir a las instituciones de salud. El contrato con esta empresa es por poco más de 20 millones de dosis.
De los 10 millones de vacunas que se comprometieron con GSK, los primeros tres millones llegarán a finales de diciembre. En enero se entregará una cantidad similar, otros dos millones en febrero y los últimos dos millones en marzo.
En relación con la composición del biológico, explicó que la producida por Sanofi contiene 15 miligramos de antígeno de virus, la sustancia que provoca la formación de anticuerpos en el organismo, en tanto la de GSK está integrada por 3.7 miligramos de antígeno y el adyuvante –también se utiliza en otras vacunas– para lograr una respuesta más intensa de los anticuerpos.
Aseguró que el nivel de eficacia en ambos productos es similar, aunque –aclaró– en el caso de la fabricada por GSK (Arepanrix) su composición puede provocar más efectos locales, como enrojecimiento en el sitio de la inyección, dolor, malestar general o fiebre, los cuales se controlan fácilmente.
Riesgo-beneficio
En entrevista por separado, especialistas del Centro de Investigaciones y de Estudios Avanzados (Cinvestav) del Instituto Politécnico Nacional afirmaron que como en cualquier otro tipo de inmunización, la vacuna contra la influenza A/H1N1 representa un riesgo-beneficio que incluye la posibilidad de reacciones alérgicas, y “no podemos descartar la posibilidad de consecuencias adversas al antígeno, pero este riesgo debe ser menor en comparación con el beneficio que recibe el paciente”, advirtieron.
Gilberto Castañeda, experto del departamento de Toxicología del Cinvestav, informó que desde este fin de semana el instituto aplicará un programa intensivo de farmacovigilancia para “detectar cualquier posible caso de reacción agresiva y atenderlo de inmediato”.
María del Ángel y Juan Ludert, expertos del departamento de Infectómica y Patogénesis Molecular, reconocieron que el biólogico se produjo bajo un esquema de “emergencia”. Sin embargo, aseguraron que “prácticamente no existe la posibilidad de que se haya fabricado de manera atropellada, saltándose algún paso del protocolo de investigación”.