Miércoles 3 de agosto de 2022, p. 2
Un estudio del Instituto de Ciencias Weizmann, publicado en Cell, muestra el desarrollo de modelos de embriones sintéticos de ratones fuera del útero con células madres cultivadas en una placa de Petri, es decir, sin óvulos fertilizados.
El método abre nuevos horizontes para estudiar cómo las células madres forman varios órganos en el embrión y, algún día, puede hacer posible el cultivo de tejidos y órganos para trasplante, utilizando modelos de fetos sintéticos.
El embrión es la mejor máquina para fabricar órganos y la mejor bioimpresora 3D; tratamos de emular lo que hace
, explicó Jacob Hanna, del Departamento de Genética Molecular del Instituto Weizmann, quien dirigió el equipo de investigación.
Señaló que los científicos ya saben cómo restaurar las células maduras a su troncalidad
: los pioneros de esta reprogramación ganaron un Premio Nobel en 2012. Pero yendo en la dirección opuesta, es decir, haciendo que las células madres se diferencien en corporales especializadas, ha mostrado ser mucho más problemático.
Hasta ahora, en la mayoría de los estudios, las células especializadas a menudo eran difíciles de producir y tendían a formar una mezcla en lugar de un tejido bien estructurado adecuado para el trasplante. Logramos superar estos obstáculos liberando el potencial de autoorganización codificado en las células madres
, indicó.
El equipo de Hanna se basó en dos avances anteriores en su laboratorio: un método eficiente para reprogramar las células madres de vuelta a su etapa más temprana, cuando tienen el mayor potencial para especializarse en diferentes tipos de células; el otro, descrito en Nature en marzo de 2021, fue el dispositivo controlado de forma electrónica para cultivar embriones de ratón naturales fuera del útero. En la investigación anterior se había usado con éxito para cultivar esos fetos naturales desde el día 5 hasta el 11.
En el nuevo estudio, el equipo se propuso hacer crecer un modelo de embrión sintético a partir de células madres de ratón ingenuas cultivadas durante años en una placa de Petri, prescindiendo de un óvulo fertilizado. Este enfoque es extremadamente valioso porque podría, en gran medida, evitar los problemas técnicos y éticos relacionados con el uso de embriones naturales en investigación y biotecnología. Incluso en el caso de los roedores, ciertos experimentos son inviables porque requerirían miles de embriones, mientras el acceso a modelos derivados de células embrionarias de ratón, que crecen en incubadoras de laboratorio por millones, es prácticamente ilimitado.
Sobrexpresar dos tipos de genes
Antes de colocar las células madres en el dispositivo, los investigadores las separaron en tres grupos. En uno, que contenía células destinadas a convertirse en órganos embrionarios, las células se dejaron como estaban. Las células de los otros dos grupos fueron pretratadas durante 48 horas para sobrexpresar uno de dos tipos de genes: reguladores maestros de la placenta o del saco vitelino.
Le dimos a estos dos grupos de células un empujón transitorio para dar lugar a tejidos extraembrionarios que sostienen al embrión en desarrollo
, sostuvo Hanna.
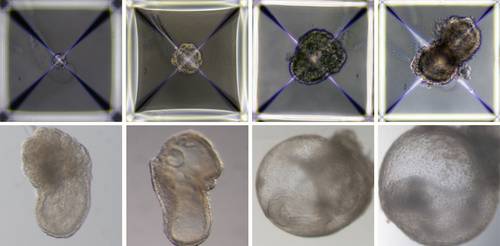
Poco después de mezclarse dentro del dispositivo, los tres grupos de células se unieron en agregados, la gran mayoría de los cuales no se desarrollaron correctamente. Sin embargo, alrededor de 0.5 por ciento, 50 de alrededor de 10 mil, pasó a formar esferas, cada una de las cuales se volvió una estructura alargada similar a un embrión.
Dado que los investigadores habían etiquetado cada grupo de células con un color diferente, pudieron observar la formación de la placenta y los sacos vitelinos fuera de los embriones y el desarrollo del modelo como en un embrión natural. Los modelos sintéticos se desarrollaron normalmente hasta el día 8 (casi la mitad de los 20 días de gestación del ratón), etapa en la que se habían formado todos los progenitores de órganos tempranos, incluido un corazón que late, circulación de células madres sanguíneas, un cerebro con pliegues bien formados, un nervio tubo y un tracto intestinal.
En comparación con embriones de ratón naturales, los modelos sintéticos mostraron una similitud de 95 por ciento tanto en la forma de las estructuras internas como en las pautas de expresión génica de diferentes tipos de células. Los órganos vistos en los modelos dieron todos los indicios de ser funcionales.
Para Hanna y otros investigadores, el próximo desafío es entender cómo las células madres saben qué hacer, cómo se autoensamblan en órganos y encuentran el camino hacia los lugares asignados dentro de un embrión. Debido a que nuestro sistema, a diferencia de un útero, es transparente, puede resultar útil para modelar defectos de nacimiento e implantación de embriones humanos
.
Esta investigación fue codirigida por Shadi Tarazi, Alejandro Aguilera-Castrejón y Carine Joubran, del Departamento de Genética Molecular del Instituto Weizmann.